综述背景
水系电池由于组装简单、安全性好、成本效益高,水系电池正成为大规模电网储能的有力竞争者。然而,独特的含水环境带来了一系列持续的挑战,阻碍了水系电池的进一步发展。这些挑战包括不稳定的金属负极和电极材料,实际应用的电化学稳定窗口(ESW)有限,以及低温条件下的电化学性能较差。这些问题都可以追溯到一个关键因素,即水系电池中的氢键(HB)化学。根据Lewis酸碱理论,H2O分子作为HB的基本组分,同时作为氢键供体(HBD)和受体(HBA)。因此,HB化学可以通过调整电荷分布、稳定晶体结构、抑制材料溶解、防止材料粉碎和加速扩散动力学对电极材料产生深远的影响。因此,全面了解HB化学的功能,并对电极材料和电解质中的HB环境实施有效的法规,对于实现优质的水性电池具有重要意义。
综述内容
鉴于此,武汉理工大学麦立强&王选朋团队在材料领域顶级期刊Advanced Materials发表综述文章“ComprehensiveUnderstandings of Hydrogen Bond Chemistry in Aqueous Batteries”第一作者为电子科技大学讲师李明。首次基于HB化学全面总结了在自放电、电极材料的结构稳定性、粉碎、溶剂化结构、载流子扩散、腐蚀反应、pH敏感性、水分裂、多硫化物穿梭等方面的关键问题,巧妙地构建了新型HB化学与各种水电池之间的复杂联系。通过采用包括材料设计、粘合剂和隔膜功能化、电解质调节和HB优化在内的优势,作者对各种水性电池中阻碍电化学性能的关键因素进行了批判性检查。最后,给出了基于HB化学的深刻的见解,旨在推动水系电池的发展。
综述要点
首次将HB化学的应用分为四个方面,并广泛讨论了其对整个电池系统的各种影响及其潜在机制,包括电解质、电极材料、粘结剂和隔膜。
总结了HB对电解质和电极材料中载流子输运的影响,特别是质子和NH4+离子。此外,我们还提出了利用HB化学增强非金属离子(H+/NH4+/Cl−/OH−)电荷存储和扩散的策略。
系统地总结了HB引入对电极材料的影响,包括晶体结构、质子扩散势垒、材料溶解度和脱溶过程。
基于HB化学,对一些有争议的问题提出了可能的解释,例如广泛报道的pH变化,水分裂,金属负极保护,电解质异常的物理化学性质以及质子插入阴极材料引起的副反应。
全面总结了基于不同HB环境调节的电解质优化策略,包括分子拥挤电解质、深度共晶电解质和高浓度盐包水电解质。此外,还详细讨论了HB对电解质的熔点、沸点、粘度、冰点等理化性质的影响。
针对HB化学在高性能水电池开发中存在的难题,提出了新的视角和具体方向,包括金属负极保护、电解质优化、正极材料、功能化隔膜、HB相关粘结剂等。
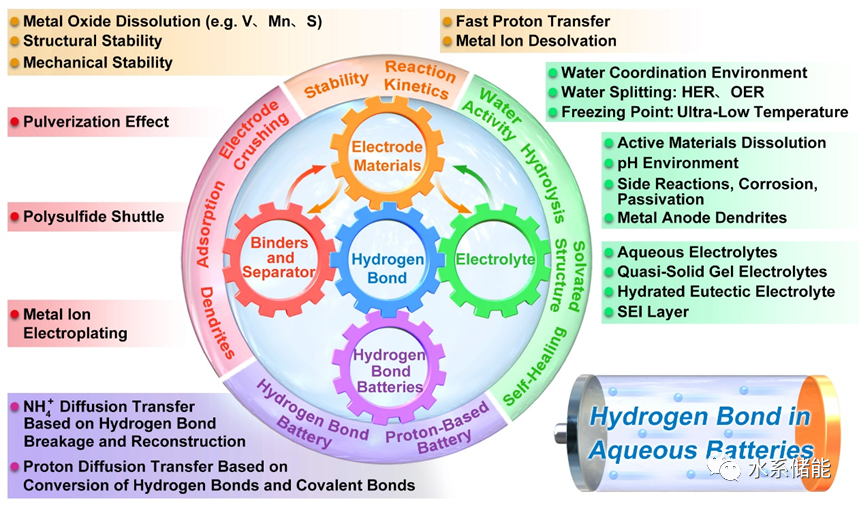
HB化学在整个水系电池系统中的应用概述
图文导读
KEY 1. 氢键的发展历史和表征威廉希尔官方网站
自从20世纪20年代Latimer和Rodebush提出HB的概念以来,HB的确切化学性质一直是一个有争议的问题,并且仍然是科学研究的关键话题。特别是近年来,HB的研究在深度和广度上都有了明显的拓展,建立了许多新的概念。所考虑的现象的复杂性急剧增加很难追踪HB概念的确切历史。如图1a所示,HB的发展大致可以分为三个主要阶段:(Ⅰ)1920~1939年的概念和确定阶段,(Ⅱ)1940~1975年的表征威廉希尔官方网站
发展阶段,(Ⅲ)1975年至今的理论计算和发展阶段。原子或分子之间不同类型的键可以归因于电子的不同分布、共享和相互作用对于共价键,其显著特征是两个或两个以上的原子共享其外层电子的使用,理想情况下达到电子饱和状态,从而形成相对稳定的化学结构。共价键具有键长短、强度高、键能高、空间取向清晰等特点。
从狭义上讲,范德华力(也称为分子力)是由分子或原子之间的偶极子引起的弱静电相互作用产生的。因此,它们明显不那么强烈,范围广泛,空间方向自由。与由强相互作用产生的共价键、金属键和离子键(化学键)不同,HB和范德华力是弱相互作用(次级键)。一般来说,HB是缺乏电子的氢原子核与具有高电负性、孤电子对或π键、部分负电荷的原子之间的一种中等范围的分子间静电相互作用。与范德华力不同,HB是饱和的、定向的、键能高的、长度短的。在HB研究的早期阶段,通常通过物理化学性质(溶解度、硬度、酸度、密度和粘度)和热力学数据(包括熔点和沸点)来研究HB对材料的影响。随着表征威廉希尔官方网站
的发展,X射线衍射(XRD)、中子散射、核磁共振(NMR)、原子力显微镜(AFM)、以光谱学为代表的红外光谱仪逐渐成为HB研究的主要方法。
图1. HB概念发展总结
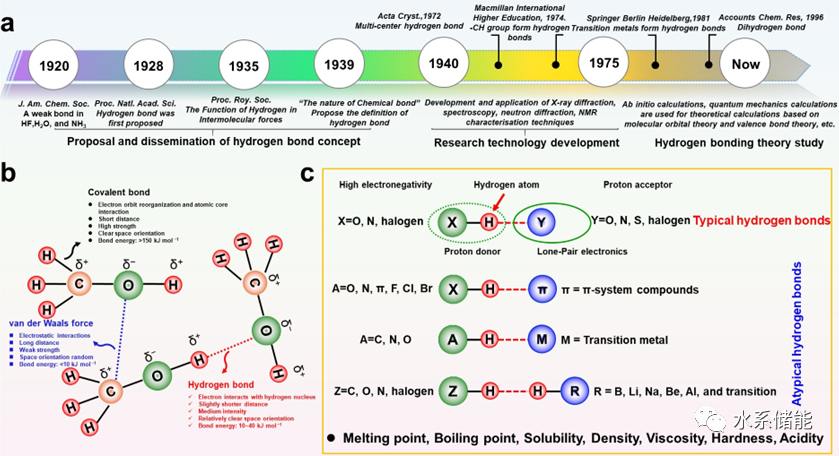
(a) HB发展时间表。(b) HB、共价键和范德华力之间的差异。(c)不同类型的HB及其组成。
KEY 2.氢键促进氢键供体/受体型非金属载流子的输运
根据电荷载体和相应电极材料的选择,水系电池是由水电解质中耦合两个电极反应组成的。考虑到离子穿梭过程的复杂性,载流子的反应动力学、电荷存储机制以及载流子与材料或电解质的相互作用是电极反应和先进水电池设计的关键因素。特别是,HB在调节穿梭电荷基水系电池中载流子的输运中起着至关重要的作用。与常见的金属载体(如Li+,Na+,K+,Zn2+,Mg2+,Ca2+,Mn2+和Al3+)不同,非金属载体如OH-、NH4+、H+、F-通过提供质子与电极材料或电解质形成HB。这一现象导致在离子插入和扩散过程中对相应的水系电池产生潜在的影响。
图2.HB化学对质子载体扩散和储存的影响
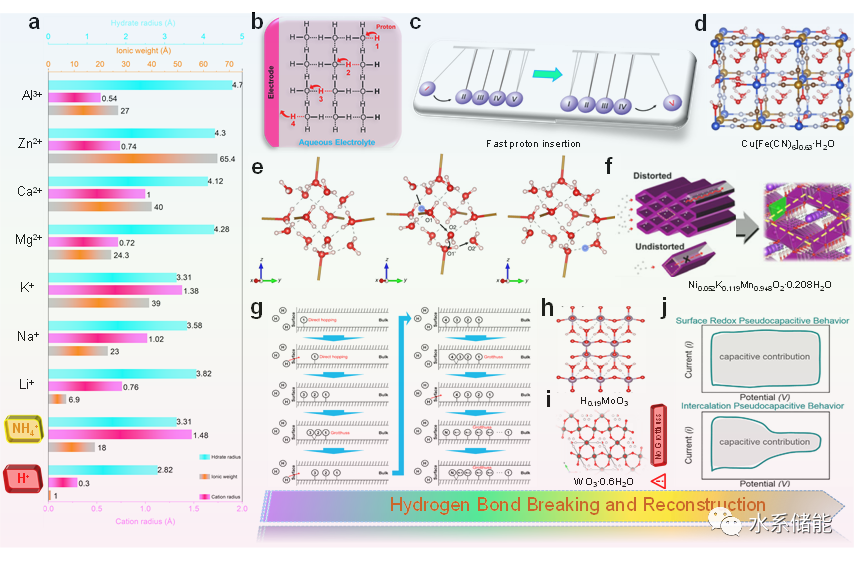
(a)对质子、铵离子和其他常见金属载体进行了比较。(b)示意图显示了水溶液中质子的快速传导。(c)牛顿摇架的原理图。(d)在特恩布尔的蓝色类似物中描绘HB。(e)密度泛函理论计算揭示了质子结合位点和转移路径。(f)结构畸变有利于MnO2中质子的快速转移。(g)说明了质子插入和扩散机制。(h)显示富质子H1.75MoO3中的HB网络。(i) WO3·0.6H2O的晶体结构单元。(j)比较了电容器和插入式伪电容的贡献。
图3. HB化学对NH4+载体扩散和储存的影响综述
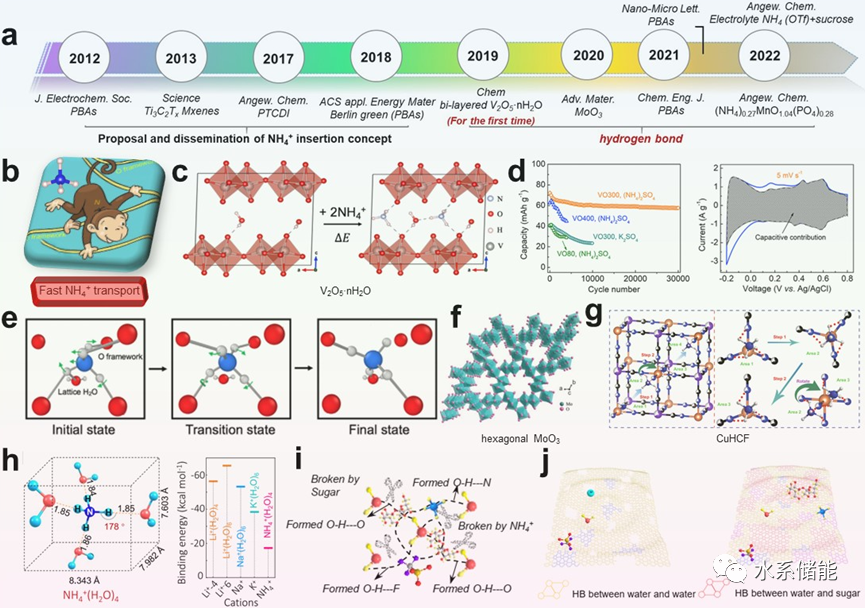
(a)铵离子电池发展时间表。(b) NH4+离子在电极材料内部扩散示意图。(c) NH4+离子插入后HB形成示意图。(d)基于NH4+离子插入的V2O5·nH2O电化学性能。(e)描述NH4+扩散机制的快照。(f)六方MoO3的结构。(g) NH4+在CuHCF中的扩散示意图。(h) NH4+离子的溶剂化结构及相应的脱溶能垒(i)相互作用示意图。
KEY 3.氢键化学在电极材料中的应用
电极材料作为水系电池最关键的组成部分之一,如何提高电极材料的综合电化学性能是目前研究的重中之重。对于插入式电极材料,面临的主要问题是(Ⅰ)由于大尺寸离子(金属离子水电池的Li+、Na+、K+、Zn2+、Al3+、Mg2+和Ca2+)的反复可逆(去)插入而造成的结构破坏;(Ⅱ)水分子侵蚀和pH值变化导致的物质溶解;(Ⅲ)多次可逆反应后体积膨胀导致物料粉碎;(Ⅳ)由于静电斥力和离子大小,电化学反应动力学缓慢。与传统的制造空位、离子掺杂/预插入、材料改性等优化策略不同,构建HB化学与电极材料之间的关系,实现电化学性能的显著提升具有深远的意义。电极材料之间或结构内HBs的形成对其物理化学性质有重要影响。它调节电荷分布,增强载流子扩散,稳定晶体结构,抑制溶解,限制H2O分子,促进脱溶。形成HB需要一个合适的HBD或HBA卡。在无机材料的情况下,引入合适的HBD通常是必要的,以形成HBs与结构氧原子,或者同时需要受体和供体。HB化学在水系电池中的作用尤其值得注意。例如,额外引入质子作为补充,显著提高了速率性能。促进H2O分子的脱溶可以有效地提高锌电极的稳定性,提高电镀/剥离效率。因此,在电极材料中合理运用HB化学具有重要意义。它可以优化各种材料的特性和性能,从而提高水电池应用中的电化学性能。
图4. HB在电极材料中的化学效应综述
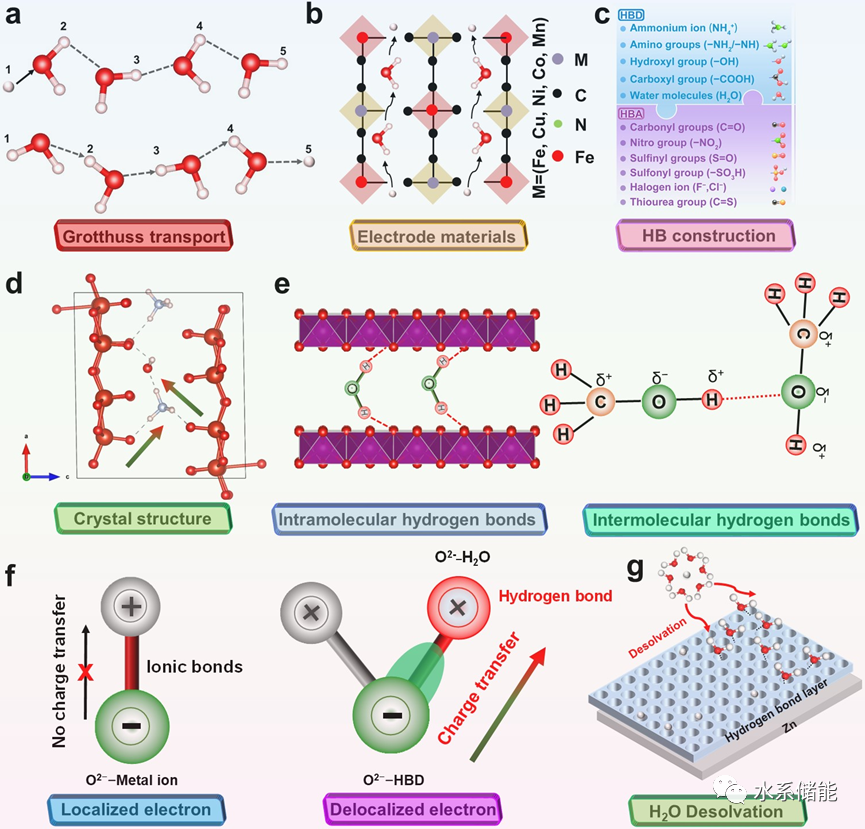
(a)基于HB的Grotthuss机理及(b)相应在电极材料中的应用。(c)可选的HB构建单元(d) HB对晶体结构的影响。(e) HB对电极材料稳定性的影响。(f) HB对电子分布的影响。(g) HB对脱溶的影响。
KEY 4. 氢键化学优化电解液pH
对于含水电解质,主要问题在于(Ⅰ)由于与标准氢电极(SHE)相比,ESW较窄,仅为1.23 V,导致水分裂导致的HER或OER;(Ⅱ)潜在的pH变化会引发副反应增加、电极腐蚀、自放电和低CE;(Ⅲ)对温度敏感,在低温(0℃)下电化学性能显著降低;(Ⅳ)由于大尺寸的水合溶剂化离子,限制了电荷携带的扩散和脱溶过程。对于理论容量较高的金属阳极,除Fe、Cu、Zn外,其他氧化还原反应电位低、反应活性高的金属均被排除在水溶液的ESW范围之外。即使对于可用的金属Zn/Fe/Cu阳极,由于枝晶形成、腐蚀反应、不可逆副产物以及电镀和剥离的低CE,水电池中的短路和快速容量衰减仍然是巨大的挑战。对于含水电解质,上述问题与H2O分子之间的HB有着密不可分的联系。
电解质中的盐水解导致pH值偏离中性,对电极材料及其电化学过程产生严重影响。大多数电解质pH < 7 .加速TMO电极材料的溶解,导致循环性能差。同时,金属电极在热力学上是不稳定的。副反应产物(通常是半导体)的钝化层的形成会阻碍可逆的电镀/剥离过程。通过引入含有HBA和HBD的pH缓冲液可以调节水解反应。该策略能够控制电极表面附近的质子浓度,使其成为开发高性能稳定电极的可行方法。
图5. HB对水解反应的化学影响综述
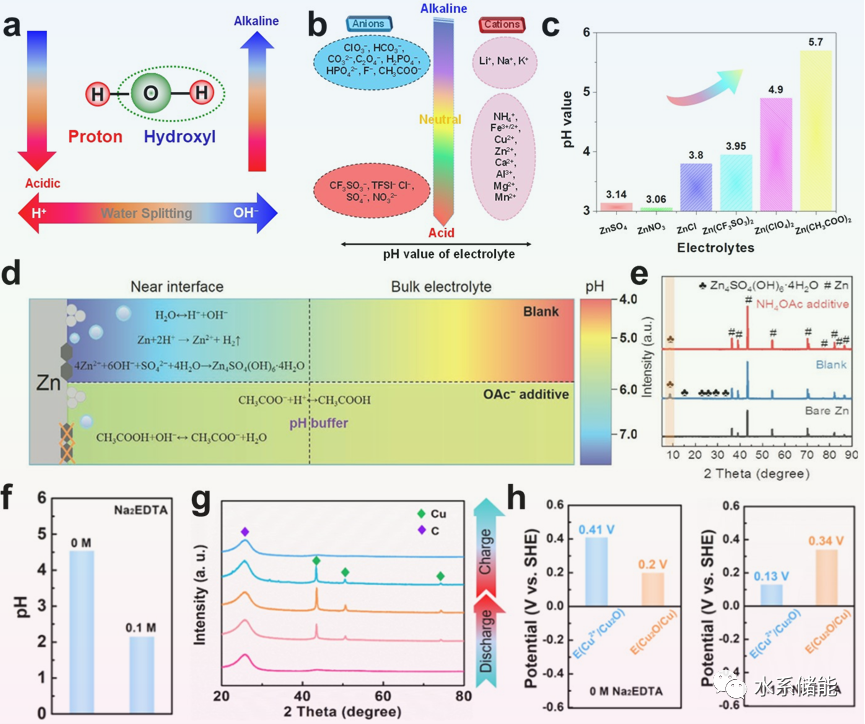
(a)水解示意图。(b)水解反应引起的电解质酸碱度差异。(c)各种锌离子电池电解质的pH值。(d)不同电解质的pH演化示意图及界面pH缓冲机理。(e)裸锌在不同电解质中浸泡7天的XRD图谱。(f)添加或不添加0.1 M Na2EDTA时电解质的pH变化。(g)镀Cu2+和剥离Cu2+的非原位XRD图谱。(h)无0.1 M Na2EDTA和添加0.1 M Na2EDTA的电解液中Cu2+/Cu2O和Cu2O/Cu的理论电极电势。
KEY 5. 氢键化学优化电解液理化性质(ESW、冰点、黏度等)
由于水分子的热力学不稳定性,传统的水电解质存在低温电化学性能差、ESW窄以及副反应等关键问题。一般来说,电解质中的水分子通常具有三种不同的HB环境:具有四面体HB网络结构的大体积H2O(具有四个HB的强HB水环境),与其他H2O分子具有平均连通性的H2O簇(具有一到三个HB的弱HB水环境),以及与环境连通性较差的孤立H2O (无HB H2O)。首先,水分子高度有序的HB结构有利于质子和氢氧化物的快速运输,导致金属阳极因H2O分裂反应(HER和OER)及其副反应而钝化和腐蚀。同时,随着温度的降低,H2O分子动能的降低不足以破坏有序的HB。HB的结构发生明显改变,有序分子运动显著增加,最终实现了低温液固冻结过程。因此,减少水电解质中H2O分子HB有序网络结构的数量对于抑制水解和降低凝固点至关重要,从而影响水电池中的ESW、电极副反应、金属阳极电镀和电极材料溶解等。
图6. HB化学对水裂解和凝固点的影响综述
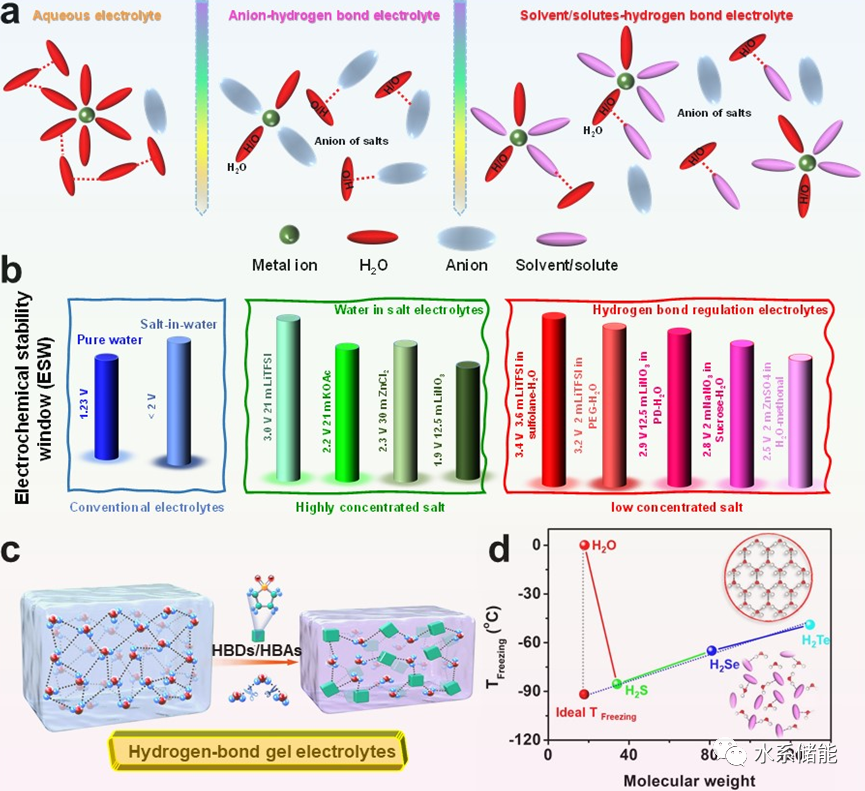
(a)常规水电解质、阴离子拥挤和分子拥挤HB电解质的示意图比较。(b)常规电解质、盐包水电解质和低盐浓度HB电解质的ESW比较。(c) HB凝胶电解质示意图。(d) H2O、H2S、H2Se、H2Te的凝固点。插入的图片比较了不同HB环境下电解质在低温下的状态。 H2O−H2O分子的有序八面体HB网络是HER/OER和凝固点发生的决定因素。引入高浓度的盐、富含HBA/HBA的添加剂以及制备准固态凝胶电解质可以破坏原有的HB网络并调节HB的类型,从而实现宽ESW并抑制电解质从液体到固体的冻结过程。因此,减少有序的H2O HB网络以及阴离子与H2O分子之间的HB配位环境对优化高浓度盐电解质至关重要。由于HBA(阴离子)的数量有限,降低盐浓度会显著影响电解质的调节。对于添加剂来说,由于携带大量的HBA/HBD官能团,即使是低添加量也会显著影响HER过程和冰点。用合适的添加剂来抑制金属阳极中HER相关的副反应是一种现实的选择。此外,不引入高浓度腐蚀阴离子(如Cl−、F−等)的HB添加剂策略显示出相当大的应用潜力。特别是,HB调节还伴随着凝固点和饱和蒸气压的降低,增强了水系电解质的环境适应性。
KEY 6. 氢键化学制备共晶电解液
与传统的低浓度“水包盐”、高浓度“盐包水”、离子液体、有机电解质等各种电解质不同,HB化学还产生了一种基于深共晶溶剂(DES)的新型电解质体系——共晶电解质,具有离子电导率高、热稳定性好、对金属阳极的保护、扩大ESW、增强低温耐受性等显著作用。优异的电化学稳定性,价格低廉,环保安全。传统电解液环境导致的SEI层不稳定、枝晶生长不受控制以及金属阳极的副反应导致了低CE、不稳定的电镀/剥离。基于HB的DES电解质为H2O分子和富含H、O、F、N、S等元素的有机基团提供了高度受限的HB环境。通过精心配置HB基DES电解质,有效拓宽了ESW,优化了溶剂化结构,促进了稳定SEI的形成。因此,它被广泛用于金属阳极保护(Zn, Mg, Al)和高输出电压,有助于实现更耐用和更高能量密度的水系电池。此外,与纯有机电解质和离子液体电解质相比,基于HB的DES电解质在开放气氛中具有优异的稳定性,具有很强的竞争力,这使得电池密封成为一种选择,而不是必需的。这些优点为水系电池带来了前所未有的灵活性和可逆性,具有优异的成本效益。
图7. HB化学对HB基DES电解质和金属阳极保护的影响综述
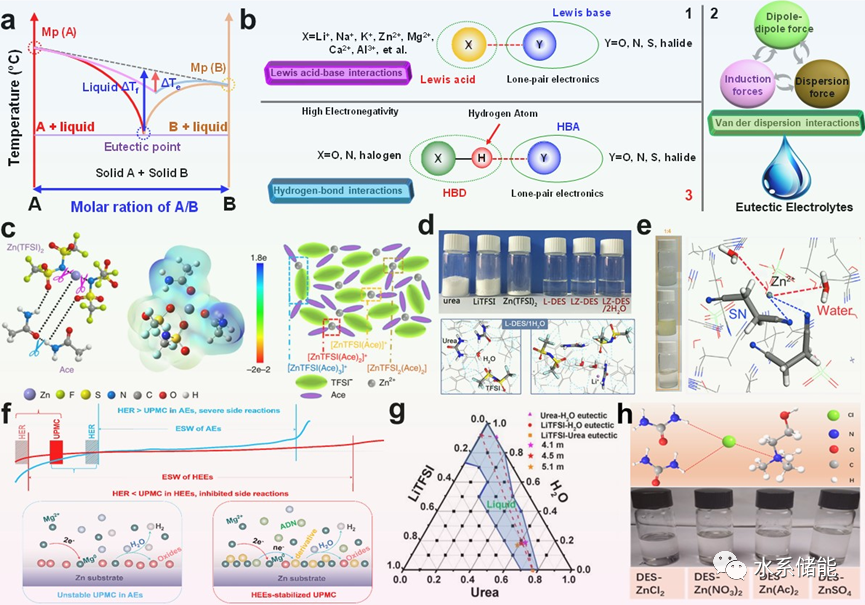
(a)双组分共晶电解质相图。(b)三种共晶电解质的形成机理。(c)锌离子电池用Ace−Zn(TFSI)2 DES电解质的溶剂化结构及形成机理示意图。(d) Zn/Li混合电池用CO(NH2)2−LiTFSI/Zn(TFSI)2HDES电解质的制备及溶剂化结构。(e)锌离子电池用ZnSO4∙7H2O、Zn(NO3)2∙6H2O、Zn(ClO4)2∙6H2O/SN HDES电解质。(f)己二腈-Mg(ClO4)2·6H2OHDES示意图,缓解了HER与Mg离子电池镀/剥离Mg之间的竞争。(g)室温下尿素、LiTFSI、H2O三元相图中的液相区。(h)用于锌离子电池的ChCl−CO(NH2)2HDES和相应的不同盐电解质示意图和照片。
KEY7.氢键化学在粘结剂中的影响
在水系电池粘结剂中引入HB可以显著提高电极材料的循环稳定性。对于大多数电极材料,离子储存过程不可避免地导致体积变化,特别是在高质量/面积载荷和高理论容量下,如石墨、硅(Si)、磷(P)、锡(Sn)、铝(Al)、锗(Ge)、砷(As)、硫(S)、碘(I2)等。例如,插层型(Si)阳极提供了很高的理论比容量(4200 mAh g−1,Li4.4Si),每Si可容纳超过4个Li+。然而,在重复的锂化/去锂化过程中,硅经历了极端的体积膨胀/收缩(超过400%),导致广泛的破裂和破碎。随后,与本体电极的电接触恶化,导致容量迅速下降和循环稳定性差。硫(S)阴极在电化学过程中,在S和Li2S之间发生高达80%的体积膨胀,不可避免地造成电极严重的粉化和结构破坏。一般来说,粘合剂对电极没有直接的电化学活性。它的作用只是连接活性物质和碳添加剂,使电极浆料粘附在集流体上。然而,聚合物粘合剂作为电池的主要组成部分之一,已被确定会影响电池的寿命、不可逆容量损失和CE。电极材料体积的剧烈变化必然导致电极材料从集流体上脱落,造成活性材料利用率低,CE低,容量衰减快。
对于HB粘结剂,需要注意以下问题。(Ⅰ)不同活性材料表面官能团的性质不同(HBA/HBD),根据HB的形成原理选择合适官能团的粘结剂是关键。(Ⅱ)与有机材料不同,由于无机电极材料刚性表面缺乏活性HBA/HBD官能团,活性材料与粘结剂之间的HB相互作用通常较弱。因此,通过表面官能团处理在材料表面引入HBA/HBD,可以获得具有更强相互作用的坚固HB。(Ⅲ)不同类型的HBA−HBD导致不同类型和强度的HB相互作用。高强度梯度HB可由两种或两种以上的粘结剂形成,发挥协同作用。值得注意的是,虽然目前关于HB粘结剂在水电池领域的报道还相当少,但对于硫基水电池、基于独特转化反应的电极材料(碘基水电池)、活性材料的超高质量/面负荷等高能量密度电池系统而言,开发HB粘结剂克服材料的粉状化,对于商业应用具有重要意义。
图8.HB对粘结剂的化学作用综述
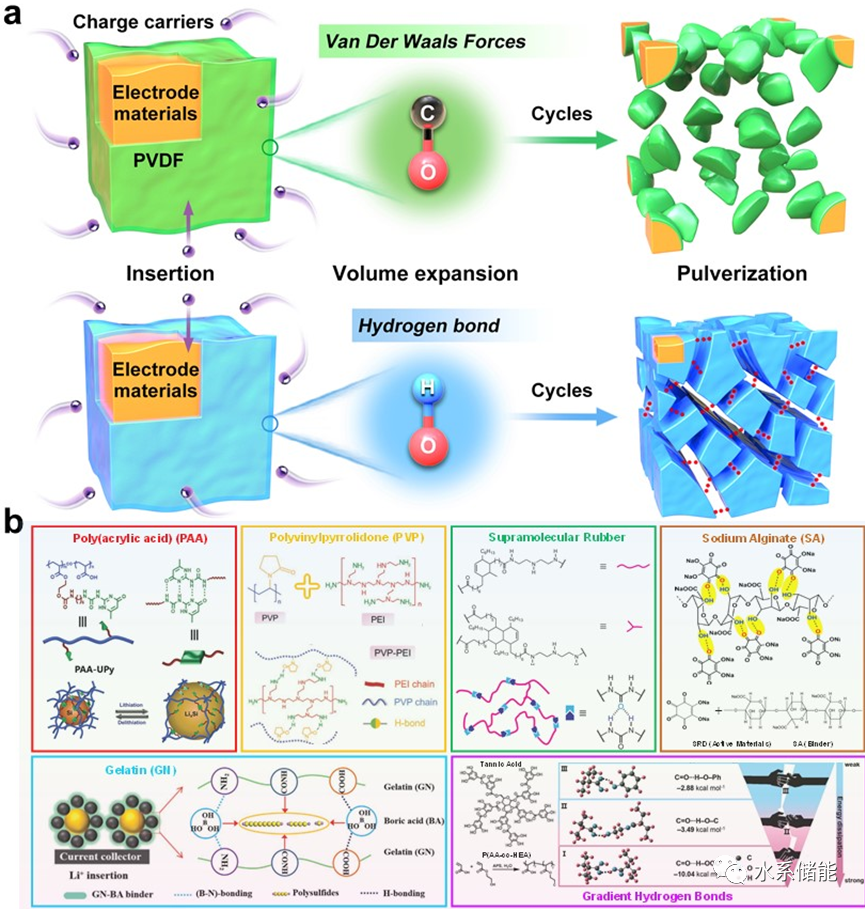
(a) HB粘结剂抑制电极材料粉碎效果示意图。(b) PAA、PVP、SR、SA、GN和梯度粘结剂几种不同类型HB粘结剂的形成过程和作用机理。
KEY8.氢键化学在隔膜中的影响
在电池系统中,隔膜被认为是必不可少的部件。它作为电解质的储存器,调节离子的运输,并产生物理分隔以防止短路。在水系电池中,隔膜通常由传统的多孔玻璃纤维(GF)、纤维素、聚酯非织造纤维、亲水系聚丙烯(PP)或Nafion材料制成。它不仅需要大量的电解液填充,而且大量不均匀的大孔、阴离子、活性H2O和H+离子会在金属阳极表面引起严重的枝晶和副反应。功能化隔膜中HB的研究仍处于初级阶段,但鉴于其巨大的潜在有效性,这并不妨碍我们提出深思熟虑的想法。隔膜作为电池必不可少的组成部分,在调节金属电极沉积过程或抑制H2/H2S逸出、H+相关金属阳极腐蚀、多硫化物穿梭效应等一系列副反应中发挥着重要作用。
图9.HB化学在隔膜的作用总结
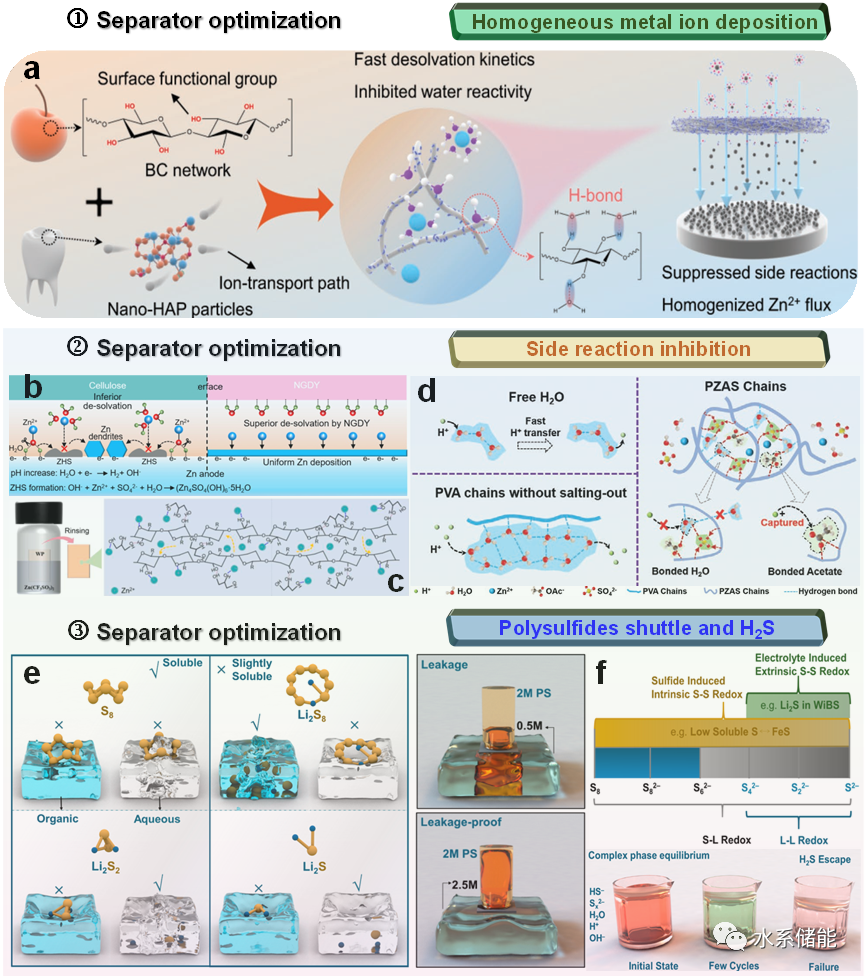
(a) HB隔膜抑制了金属枝晶的生长。(b) HB隔膜加速脱溶过程。(c) HB隔膜抑制Zn负极腐蚀。(e)硫基材料在SOB和SABs中的溶解度以及相应的可溶性短链多硫化物穿梭和化学交叉示意图。(f)S−L/S−S路线的代表性氧化还原和H2S气体析出的副反应。
总结与展望
HB对电极材料、电荷载流子输运、电解质环境、储能过程都有重要影响,最终体现在电化学性能上。HB的特异效应可分为微观和宏观两种。从微观角度看,HB作为次级键,表现出强烈的静电相互作用。它可以显著改变电解质中质子、OH−、NH4+离子和其他常见HBD的输运方式,以及基于Grotthuss或猴子摇摆机制的大块电极材料内的扩散途径。独特的传输机制和高效的离子传输增强了氧化还原反应过程和离子插入,特别是激活了水金属离子电池中额外的质子存储。因此,HB化学对电池的倍率性能(功率密度)和比容量(能量密度)有重大的提升,特别是在高电流密度下。
此外,HB对H2O分子的吸引和限制作用可以降低脱溶的能垒,从而促进脱溶过程和金属(Zn/Cu)的电镀。此外,通过改变水分子的HB环境,可以抑制水分子的反应性,有效地抑制H2O的分裂以及相关的副反应。电化学性能的提高体现在金属阳极的循环稳定性和电镀/剥离效率的显著提高上。从宏观上看,材料/粘结剂中的HB可以改变电极材料的结构/机械稳定性,导致在常见的锰氧化物、钒氧化物、PBAs和有机化合物中观察到的材料在电解质中的溶解被抑制。因此,水系电池的循环性能有了显著的提高。此外,HB的强吸附和约束效应可以减轻高能硫基、硒基和碘基正极材料在转化反应中因体积膨胀造成的粉化。在电解质方面,破坏水分子的HB网络环境对降低凝固点和饱和蒸汽压有显著的影响,从而提高了水系电池在干热低温等各种环境条件下的电化学性能和适应性。此外,优化H2O分子HB环境可以有效调节pH值,精确管理直接参与质子/OH−相关反应的H2、O2、H2S等气体的逸出。这种优化有助于维持稳定的电化学环境,提高水系电池的整体性能。
此外,受限制的质子/OH-离子环境有助于防止金属和氧化物电极材料在酸性或碱性条件下的自发腐蚀。因此,这有效地减轻了水电池在静息过程中的自放电现象。含有极性官能团的HBA或HBD可能会锚定多硫化物,抑制SABs中的穿梭效应,从而防止阴极材料的损失,延长循环寿命。从宏观上看,材料/粘结剂中的HB可以改变电极材料的结构/机械稳定性,导致在常见的锰氧化物、钒氧化物、PBAs和有机化合物中观察到的材料在电解质中的溶解被抑制。因此,水系电池的循环性能有了显著的提高。
此外,HB的强吸附和约束效应可以减轻高能硫基、硒基和碘基正极材料在转化反应中因体积膨胀造成的粉化。在电解质方面,破坏水分子的HB网络环境对降低凝固点和饱和蒸汽压有显著的影响,从而提高了水系电池在干热低温等各种环境条件下的电化学性能和适应性。此外,优化H2O分子HB环境可以有效调节pH值,精确管理直接参与质子/OH−相关反应的H2、O2、H2S等气体的逸出。这种优化有助于维持稳定的电化学环境,提高水系电池的整体性能。此外,受限制的质子/OH-离子环境有助于防止金属和氧化物电极材料在酸性或碱性条件下的自发腐蚀。因此,这有效地减轻了水电池在静息过程中的自放电现象。含有极性官能团的HBA或HBD可能会锚定多硫化物,抑制SABs中的穿梭效应,从而防止阴极材料的损失,延长循环寿命。
审核编辑:刘清
-
电解质
+关注
关注
6文章
811浏览量
20051 -
红外光谱仪
+关注
关注
1文章
63浏览量
10239 -
XRD
+关注
关注
0文章
132浏览量
9074 -
NMR
+关注
关注
0文章
10浏览量
6935 -
载流子
+关注
关注
0文章
134浏览量
7651
原文标题:武汉理工大学麦立强&王选朋AM综述:全面论述水系电池中氢键关键作用!
文章出处:【微信号:清新电源,微信公众号:清新电源】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐
【Amphenol】安费诺解锁自主机器人潜力 | 电池管理系统的关键作用
工控机在现代工业中的关键作用
行星搅拌在锂离子电池液中的关键作用

为什么带有盐桥的原电池比不带有盐桥的原电池电流持续时间长?
M8_8pin接头在电子设备中的关键作用

声光偏转器(AODF)在高速荧光成像中的关键作用:FIRE威廉希尔官方网站 简介

导热氧化铝粉用在动力电池中的作用
WiFi模块引领智能制造时代:工业4.0中的关键作用
语音数据集在智能驾驶中的关键作用与应用
DC电源模块在物联网设备中的关键作用





 全面论述水系电池中氢键关键作用!
全面论述水系电池中氢键关键作用!











评论