肿瘤细胞间的交流对肿瘤的发生及发展具有重要意义。细胞外囊泡(EVs)是细胞分泌的纳米或微米尺度的囊泡,通常根据其大小或形成/释放途径分为外泌体、微囊泡和凋亡小体等。近年来,研究证实EVs是细胞间重要的信号传递载体,EVs正在成为新兴的有前景的癌症诊断生物标志物。2016年,日本科学家Yoshinori Ohsumi因揭示自噬机制而获得诺贝尔生理学或医学奖。该机制中,自噬被描述为一种分解代谢途径。但最新研究表明,自噬小体可以从细胞内降解途径转化为细胞外分泌途径,形成另一种EV类型,即分泌型自噬小体。最近的研究表明,分泌型自噬小体与肿瘤细胞增殖、转移及不良预后相关,揭示了分泌型自噬小体在肿瘤进展研究中的潜在作用。因此,更好地了解分泌型自噬小体内部或表面的内容物对实现癌症诊断和探索其在癌症进展中的作用具有重要意义。
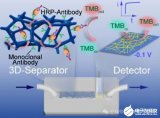
近期,东南大学刘松琴教授课题组报道了一种三维微流控芯片,用于分泌型自噬小体的高效捕获与表面蛋白灵敏检测(图1)。相关成果以“Three-Dimensional Microfluidic Chip for Efficient Capture of Secretory Autophagosomes and Sensitive Detection of Their Surface Proteins”为题发表在国际化学权威杂志Analytical Chemistry上。论文通讯作者为刘松琴教授,共同第一作者为青年教师华鑫及硕士生刘晰。
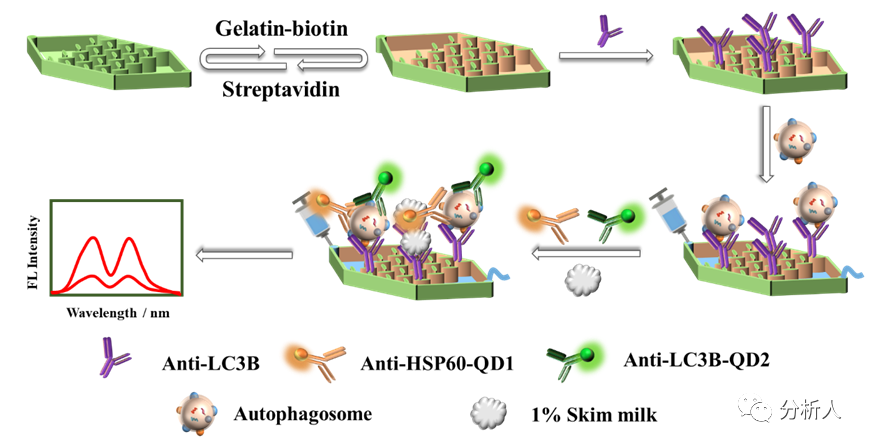
图1 基于三维微流控芯片的分泌型自噬小体高效捕获与表面蛋白检测示意图
研究人员构建了一种具有纺锤形微柱阵列结构和明胶逐层修饰的三维(3D)微流控芯片(图2)。之前的研究表明,微柱阵列可以在流体通过微通道时产生各向异性流动,从而增加溶液中的反应物与微通道表面之间的接触概率。有限元interwetten与威廉的赔率体系 结果表明,微柱阵列中存在一个非对称流分叉,这种各向异性流动可以增强相对较大的自噬小体在LC3B抗体修饰微通道表面的传质。流体流过阵列通道的时间越长,自噬小体与抗体发生反应的机会就越大。此外,由于横截面上速度分布不均匀导致的二次Dean流进一步增加了自噬小体与LC3B修饰微通道表面相互作用的概率。另外,通过多层生物素化明胶修饰,增加了捕获抗体的固定位点。因此,3D芯片的自噬小体捕获效率(74%)明显高于未修饰的平板芯片(47%)。
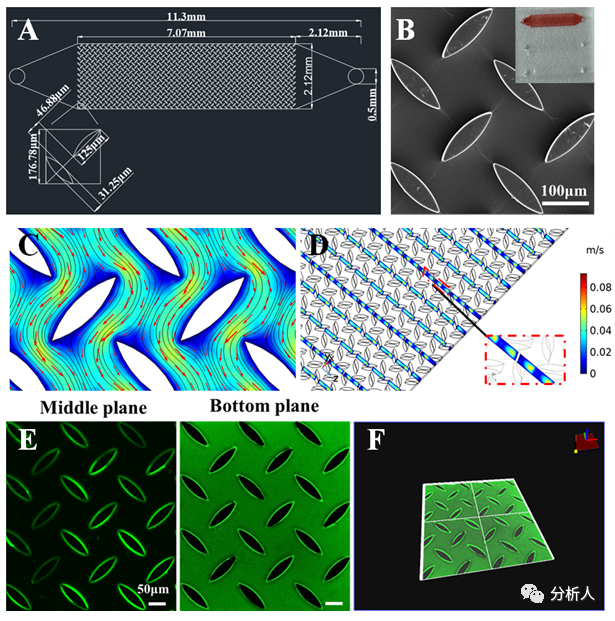
图2 (A)微流控芯片设计图;(B)分布在芯片内的梭状微柱阵列的SEM图像;(C-D)有限元模拟通道宽度方向上的流动模式(C)和通道长度方向上的横向流动剖面图(D);(E-F)CLSM对涂有生物素化明胶薄膜和链霉亲和素-FITC的芯片进行平面扫描(E)和3D扫描(F)图像。
利用所制备的两种抗体-量子点偶联探针,该芯片采用两步免疫反应及荧光分析,成功捕获并检测了卵巢癌细胞分泌的自噬小体。结果表明,该芯片可对分泌型自噬小体表面的两种蛋白LC3B和HSP60实现灵敏检测,检出限(LODs)分别为141粒子/μL和126粒子/μL。此外,自噬小体上LC3B和HSP60的表达均可用于区分癌症患者和健康人群的血清样本,其p值分别小于0.01(具有显著统计学差异)和0.05(具有统计学差异)。另外,LC3B与HSP60信号加和的p值小于0.001(具有极显著的统计学差异),表明该芯片在癌症诊断方面具有良好的应用潜力(图3)。
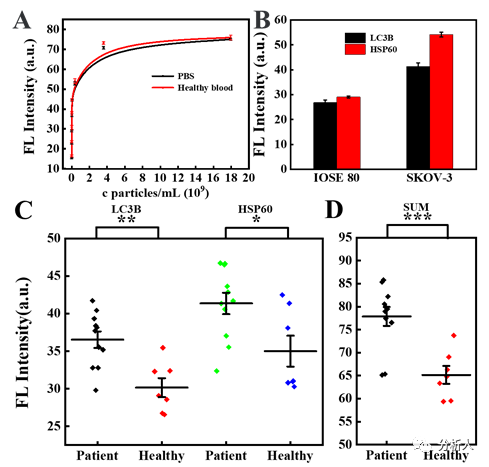
图3(A)在PBS和健康人血清中添加自噬小体标样LC3B的检测;(B)两种细胞在相同体积的细胞培养上清中收集的自噬小体中LC3B和HSP60的表达;(C)卵巢癌患者临床标本与正常人自噬小体LC3B和HSP60表达比较;(D)卵巢癌患者和正常人的临床样本中自噬小体LC3B和HSP60信号的总和。(*p<0.05,**p<0.01和***p<0.001)。
综上所述,研究人员设计了一种用于分泌型自噬小体分离检测的三维微流控芯片。芯片采用梭状微阵列结构和明胶层修饰,不仅增加了芯片内部的表面积,也增加了流体和芯片之间的接触时间和抗体的修饰位点,大大增强了自噬小体的捕获效率。随后,采用两种抗体偶联量子点探针,实现了芯片中多个自噬小体表面蛋白的同时检测,灵敏度高、样品消耗低。此外,对临床血清样本中的自噬小体检测结果表明,该芯片在准确区分癌症患者和健康人群方面具有良好的可行性,这表明该策略在临床癌症诊断中具有良好的应用前景。
论文链接:
https://doi.org/10.1021/acs.analchem.2c01419
编辑:黄飞
-
芯片
+关注
关注
455文章
50732浏览量
423278 -
微流控芯片
+关注
关注
13文章
271浏览量
18834 -
微流控
+关注
关注
16文章
526浏览量
18891
原文标题:基于纺锤形微柱阵列的三维微流控芯片,用于分泌型自噬小体分离检测
文章出处:【微信号:Micro-Fluidics,微信公众号:微流控】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐
如何快速高效的完成汽车前盖板的三维检测?
广西扫描服务三维检测三维扫描仪
Handyscan汽车三维扫描服务尺寸检测的应用
怎样去设计一种基于RGB-D相机的三维重建无序抓取系统?
一种新颖的三维模型压缩算法
一种用于外泌体分离富集和检测的微流控芯片
三维扫描威廉希尔官方网站 用于家用气瓶形变检测装
武汉大学:研究微流控电化学集成传感器,快速、高效分离和灵敏检测致病菌




 一种用于分泌型自噬小体分离检测的三维微流控芯片
一种用于分泌型自噬小体分离检测的三维微流控芯片










评论