3D肿瘤模型是一种极具潜力的抗肿瘤药物评估平台,不仅能够弥补现有2D模型的不足,也能interwetten与威廉的赔率体系 体内复杂的肿瘤微环境。
鉴于此,韩国科学威廉希尔官方网站 研究院的Kim团队开发了一种用于评估药物体外递送效果的肺-肿瘤-血管芯片模型,并探究了影响肿瘤血管形成的关键因素。相关研究成果以“Vascularized Lung Cancer Model for Evaluating the Promoted Transport of Anticancer Drugs and Immune Cells in an Engineered Tumor Microenvironment”为题,发表在Advanced healthcare materials上。
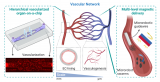
据麦姆斯咨询介绍,研究人员选用水凝胶设计了三个平行通道,右侧通道用于肺成纤维细胞(HLF)和肿瘤球(A549)的共培养,其他通道负责氧气的供给以及血管内皮细胞(HUVECs)的培养。研究人员利用HUVECs和HLF形成血管并通过改变周围储液槽中的体积差来控制间质流动的方向,待血管形成后引入肿瘤球。
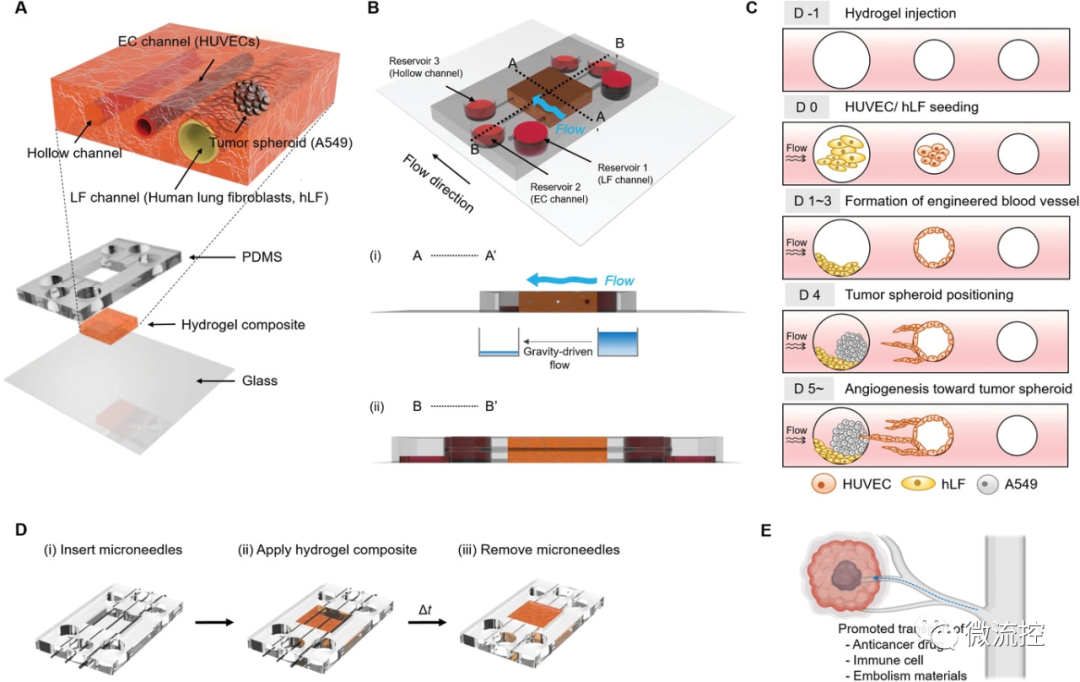
图1 肺-肿瘤-血管芯片示意图
随后,研究人员分别探究了间质流动和HLF对于肿瘤血管形成的影响,结果显示当只存在间质流动时,才会萌发新生毛细血管,且血管形成方向与间质流动方向相反;当只存在HLF时,毛细血管的萌发成连续状态;当间质流动和HLF均存在时才会形成完整的毛细血管网。
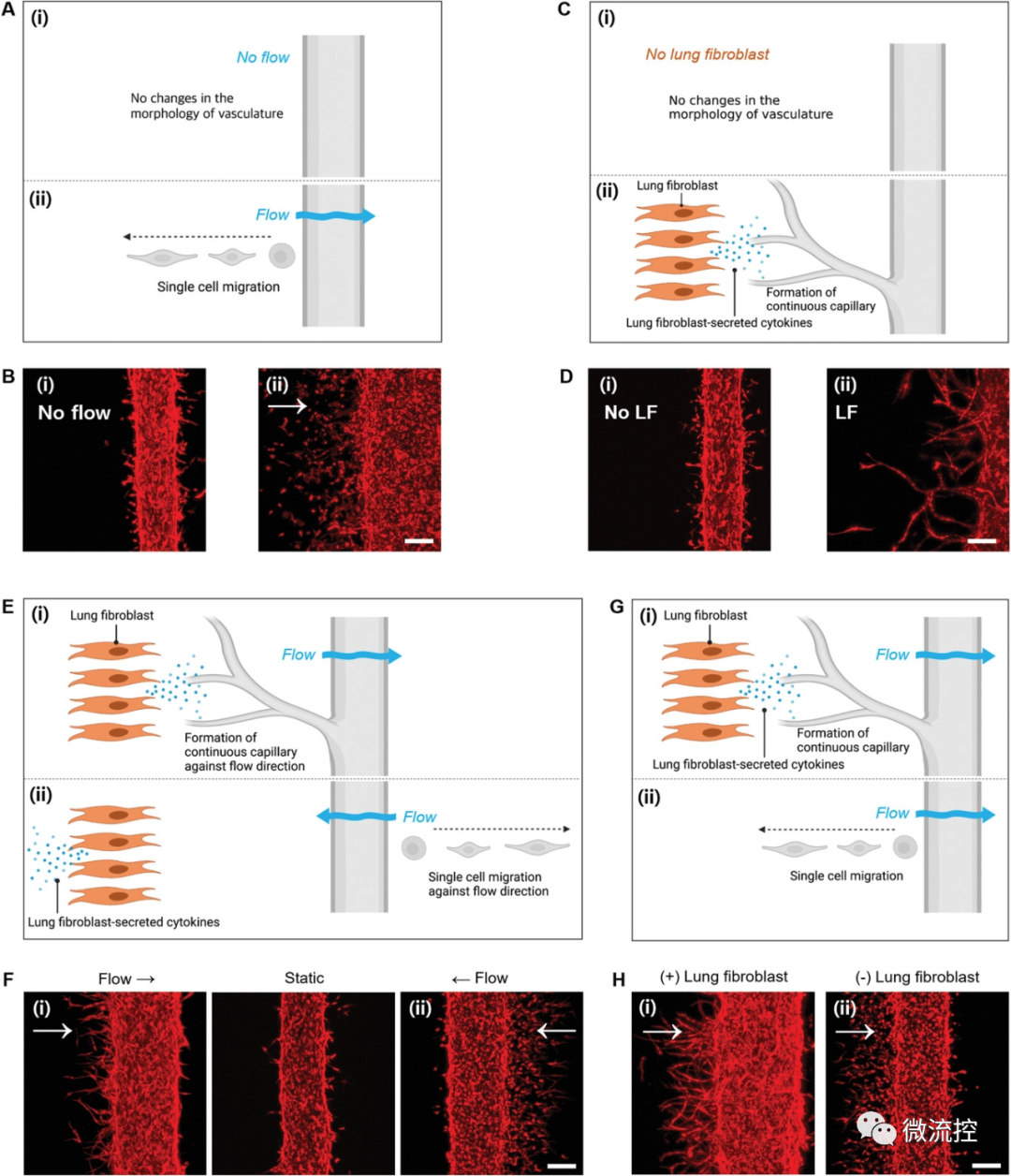
图2 肿瘤血管生成的决定性因素
接着,研究人员进一步考察了间质流动、HLF和肿瘤球三个因素的组合对于肿瘤血管生成的影响。当HLF和间质流动同时存在时,血管覆盖面积显著增加,肿瘤球的存在对于血管面积的变化并没有显著影响,血管发芽时间的长短和主干血管的直径也显示出相似的规律。意外的是,研究人员发现肿瘤球的加入会延缓肿瘤血管的生成,这可能与A549本身的性质有关。
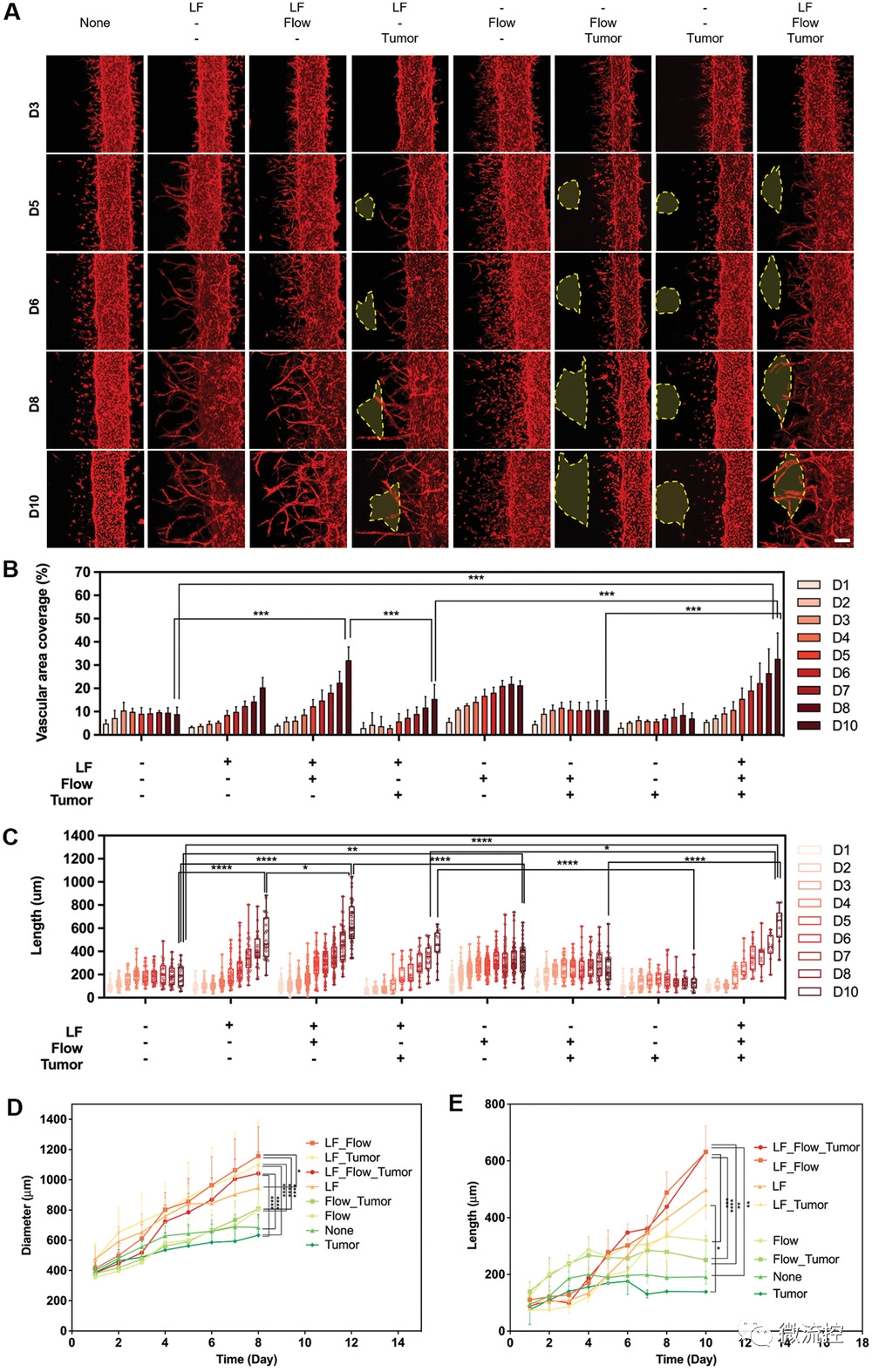
图3 间质流动、HLF和肿瘤球对肿瘤血管形成的影响
为了验证芯片中培养的血管三维结构和可视化血管标志物(VE-钙粘蛋白)的表达,研究人员使用Z-STACK影像堆叠拍照系统,并发现来自于主干血管的VE-钙粘蛋白在毛细血管中有显著的表达。将异硫氰酸荧光素(FITC)-葡聚糖溶液通过主干血管注入后,发现在毛细血管中可以观察到FITC-葡聚糖。这证实了肿瘤血管周围复杂微环境的形成,说明该模型可用于药物的评价。
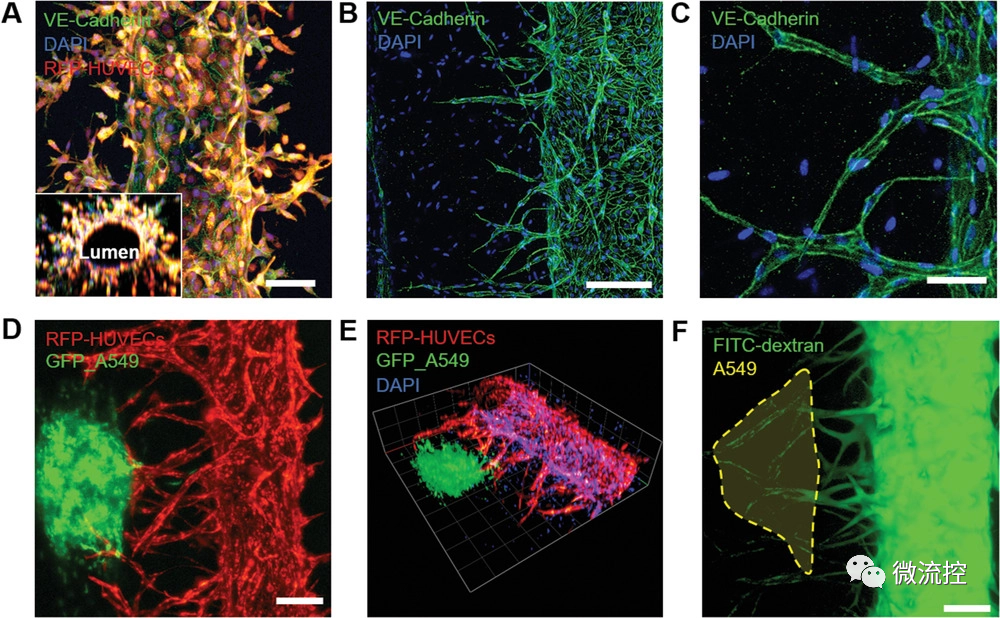
图4 3D肿瘤血管模型的免疫荧光图像
接着,研究人员评估了肺-肿瘤-血管芯片模型在药物递送、免疫细胞输送以及毛细血管栓塞方面的应用。给予主干血管盐酸阿霉素(DOX)处理后,与非血管化的肿瘤芯片相比,该模型的肿瘤尺寸和肿瘤生长速率更小,且DOX的细胞摄取更多。该结果表明萌发的毛细血管可以更有效的将抗癌药物递送到肿瘤部位。
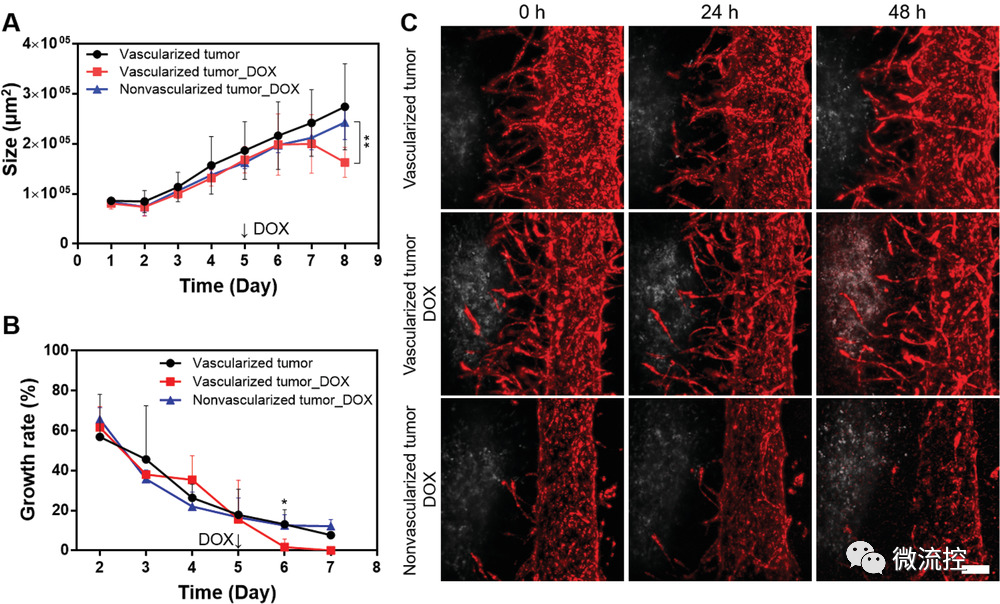
图5 肺-肿瘤-血管芯片模型对于DOX的治疗效果评价
研究人员选用急性单核细胞白血病细胞系(THP-1)测试了该模型在评估癌症免疫治疗方面的应用。结果发现,在非血管化的肿瘤芯片中,THP-1仅存在于主干血管;而在肺-肿瘤-血管芯片中,THP-1能够通过毛细血管到达肿瘤附近。该结果表明此芯片模型可用于评估癌症免疫治疗。
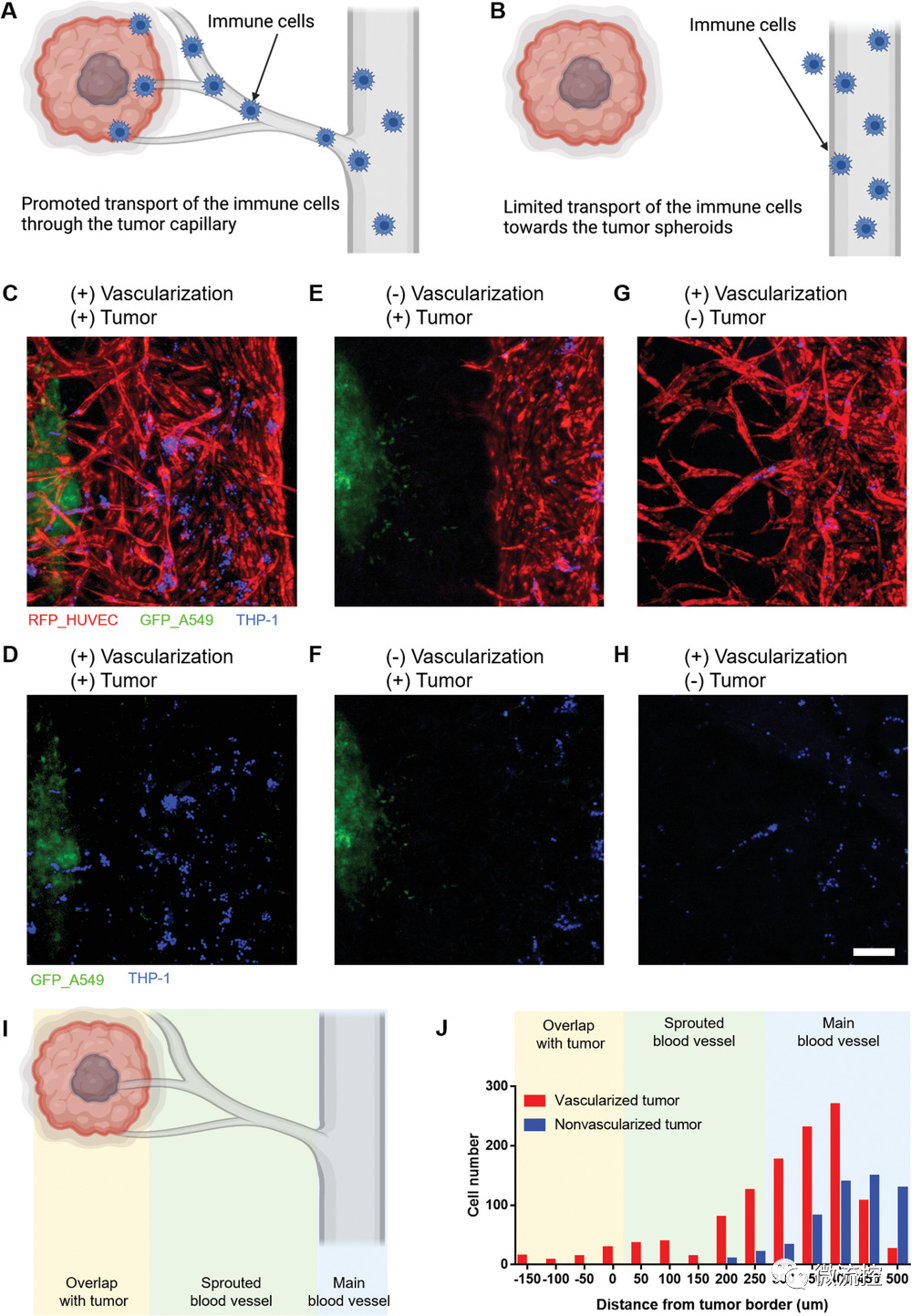
图6 肺-肿瘤-血管芯片中THP-1递送效果的评估
最后,研究人员利用肺-肿瘤-血管芯片平台测试了栓塞策略能否用于靶向肿瘤毛细血管。首先研究人员使用了DOX共轭液态金属(EGaIn)粒子,并通过重力驱动由主干血管引入。结果发现DOX-EGaln可以输送到毛细血管中,并且即使在流动状态下,DOX-EGaln仍然可以留在毛细血管内。这表明肿瘤毛细血管栓塞的形成。但即使在栓塞后,肿瘤周围也具有足够多的营养物质,所以无法表征栓塞策略的抗肿瘤效果。

图7 DOX-EGaln对肿瘤毛细血管的栓塞作用
综上所述,研究人员利用肺-肿瘤-血管芯片模型探究了肿瘤血管生成的影响因素,并对该模型在药物体外递送、免疫细胞输送以及毛细血管栓塞方面的应用进行了评估,证明了该肺-肿瘤-血管芯片模型用于抗癌药物的筛选和癌症免疫治疗评估方面的潜力。
论文链接:
https://doi.org/10.1002/adhm.202102581
审核编辑 :李倩
-
芯片
+关注
关注
456文章
50908浏览量
424488 -
模型
+关注
关注
1文章
3255浏览量
48902
原文标题:用于评估药物体外递送效果的肺-肿瘤-血管芯片模型
文章出处:【微信号:Micro-Fluidics,微信公众号:微流控】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐
Google AI最新应用,成功辨识肿瘤突变影像
东京大学研发血管芯片 有助开发抑制肿瘤血管新生药物
有没有可能发展出稳定的水凝胶微流控芯片制造方法?
一种新型智能量子点组装体通过负载化疗药物实现了肿瘤的高效治疗
一种基于微流控的微型肿瘤芯片
基于微流控的血管芯片来模拟人体血管内部剪切力分布状况
一种近红外光响应的脂质体纳米药物递送平台开发
一种基于微流控的血管芯片模型设计
使用原代肿瘤细胞进行药物筛选的数字微流控系统




 一种用于评估药物体外递送效果的肺-肿瘤-血管芯片模型
一种用于评估药物体外递送效果的肺-肿瘤-血管芯片模型










评论